Los anticuerpos, tecnología de anticuerpos recombinantes.
Esta vez, me salto la sugerencia de tema propuesta para el XVI Carnaval de Biología, etología, que hospeda @BioTay.
En su lugar me dedicaré a escribir la primera parte de un tema que me ha interesado, los anticuerpos scFv.
Debido a que toda la información la estoy tomando de un sólo artículo y es largo, voy a dividir en varias partes.
Los anticuerpos
Los anticuerpos son el sistema de defensa que poseen los organismos superiores cuya función es la de identificar y neutralizar objetos extraños que se introducen en los organismos, tales como virus y bacterias.
Imagen tomada de http://jcp.bmj.com/content/57/9/912/F1.medium.gif
Cada uno de los anticuerpos puede reconocer a un único antígeno específico como su blanco, esto se debe a que posee un sitio de unión al antígeno (el extraño). A este sitio de unión se le llama parátopo, una estructura análoga a una cerradura. El parátopo se localiza en la parte superior de las puntas de la forma de "Y" de las moléculas de antígeno.
Fig tomada de http://img.tfd.com/mk/D/X2604-D-25.png
El parátopo es específico para un epitopo particular, análogo a una llave, expuesto por un antígeno particular. De esta manera las dos estructuras se unen de manera altamente específica.
Fuente: http://classes.midlandstech.edu/carterp/Courses/bio225/chap17/17-05ac_Antibody_1.jpg
Este mecanismo permite que un anticuerpo pueda "marcar" a un microbio o a una célula infectada para que éstas puedan a ser "atacadas" por otros miembros del sistema inmune y así poder neutralizar directamente a su blanco.
La tecnología de anticuerpos recombinantes.
Siendo parte fundamental del sistema inmune, los anticuerpos representan un sistema de armas poderosas para la defensa de nuestro cuerpo contra agentes externos. Pero, para interactuar con la cantidad posible de estructuras extrañas, se necesita un número enorme de moléculas diferentes, con especificidades diferentes. Esta diversidad se produce a través de procesos de recombinación somática e hipermutagénesis en un set de genes variables.
Figura original de http://www.nature.com/nbt/journal/v23/n9/images/nbt1126-F1.gif
En el sistema inmune, se crea una gran colección de diferentes sitios de unión al anticuerpo debido al arrelo combinacional de los segmentos codificados geneticamente (V, D y J para la región variable de la cadena pesada VH, V y J para la región variable de la cadena lijera VL). Este proceso de reorganización tiene mayor diversidad en el repertorio primario en el centro del sitio de unión, las dos regiones CDR3 de las cadenas pesada y lijeras, respectivamente, creando una diversidad química que es de principal importancia para el reconocimiento potencial de muchos tipos diferentes de estructuras antigénicas.
En el esquema se puede ver en verde la superficie sitio de unión al anticuerpo, se indica como H3 y L3. Las otras regiones hipervariables/CDR (indicadas con H1, H2, L1 y L2) son codificadas por las líneas germinales humanas por approximadamente 100 diferentes segmentos funcionales de genes de V; desde una perspectiva estructural, están localizados en la periferia de la superficie del sitio de unión rodeando las regiones H3 y L3 (los niveles bajos de diversiad se representan en verde claro). El sitio de exposición al antígeno, (en rojo) se selecciona a partir del repertorio naïve de los linfocitos que producen anticuerpos reactivos al antigeno y disparan la incorporación de mutaciones somáticas en los genes V (indicado por las líneas verdes a nivel clonal) y la subsecuente selección de mutaciones que mejora la afinidad del anticuerpo por el antígeno (las estrellas y círculos verdes a nivel clonal y de la biblioteca, respectivamente). Las bibliotecas de anticuerpos recombinantes se hacen rescatando genes de varias mezclas de genes V; dependiendo de la construcción precisa, pueden contener una mezcla de genes V de ambas fuentes linfocitos naïve B y células (indicadas por la flecha punteada). Hoogenboom H.R. Selecting and screening recombinant antibody libraries, Nature Biotechnology 23, 1105 - 1116 (2005).
Los avances en la tecnología de anticuerpos recombinantes logrados durante la década pasada, han facilitado la manipulación genética de fragmentos de anticuerpos.
Original de http://legacy.genwaybio.com/images/gw_static/gw_technologies/gw_technologies_antibody_development_recombinant_antibodies_4015_1.gif
La manipulación genética de anticuerpos recombinantes ha mejorado nuestro entendimiento sobre las estructura y organización funcional de las inmunoglobulinas. Así, los avances han permitido el desarrollo de una larga variedad de moléculas de anticuerpo construidos mediante ingeniería genética para fines de investigación, diagnóstico y terapia con especificidades diferentes y fuera del alcance de la tecnología de anticuerpos convencional.
Fuente: http://www.bioscience.org/2008/v13/af/3024/fig1.jpg
Una vez clonados los anticuerpos, es posible incrementar su afinidad y la especificidad de unión de antígeno empleando la hipermutación somática durante la respuesta inmune. Así, se hizo posible reemplazar las prácticas existentes de inmunizaciones en modelos de animales y el desarrollo de hibridomas a través del empleo de un sistema de bacterias capáz de sintetizar y expresar, prácticamente, cantidades ilimitadas de anticuerpos de casi cualquier antígeno.
La tecnología de hibridomas fue introducida, desde 1975 por Kolher y Milstein esta tecnología permite alcanzar una especificidad definida en anticuepros monoclonales y también permite su producicción en calidad consistente así como en grandes cantidades en el laboratorio. Desde entonces, los anticuepros monoclonales (mAbs, del inglés monoclonal antibodies) han sido ampliamente utilizados dado que pueden ser producidos en cantitades ilimitadas para unirse prácticamente a cualquier antígeno y su empleo puede estandarizarse más fácilmente. Además de los anticuerpos monoclonales, las células de hibridomas, que ya son producidas exitosamente, pueden servir como materia prima para la generación de fragmentos de Fab (Uno de los fragmentos que se obtiene tras la degradación enzimática con papaína de las inmunoglobulinas (v.). Corresponde al lugar de unión con el antígeno. Este término se corresponde con las siglas inglesas fragment antigen binding) o de Fv (Fracción variable) en células linfoides y no linfoides.
Original de: http://www3.imperial.ac.uk/pls/portallive/docs/1/28871698.JPG
Durante el desarrollo de los anticuerpos monoclonales se presentaron ciertas dificultades: dado que son de origen murino se podían crear anticuerpos humanos anti-ratón (HAMA, del inglés human anti-mouse antibody), cuando son introducidos en humanos, lo que limita sus aplicaciones clínicas. Aunado a esto, la tecnología de producción de anticuerpos monoclonales resulta muy laboriosa y consumidora de tiempo. Además, los mamíferos pequeños como los ratones no siempre proporcionan la respuesta de anticuerpos de alta afinidad hacia un antígeno particular necesario para el desarrollo de un ensayo sensible. Estas limitaciones de las técnicas tradicionales de producción de anticuerpos han permitido a varios grupos investigar el uso de la tecnología de "phage display" para la producción de anticuerpos scFv (del inglés single-chain variable fragment: scFv).Imagen tomada de http://www.dyax.com/static/cms_workspace/images/phage_display.png
El avance desicivo para la expresión exitosa de fragmentos de anticuerpo en bacterias competente de E. coli se diseñó de manera que permitiera ser introducido en varios tipos de vectores (por ejemplo, fagemidos) para ser usados en en la construcción de los anticuerpos recombinantes. Estos vectores permiten la secreción de anticuerpos solubles al espacio periplásmico, como consecuencia oxidan el entorno, lo que contribuye a formación correcta de puentes disulfuro entre los dominios de anticuerpos.
Fuente: http://www.keratin.com/az/ch5a.gif
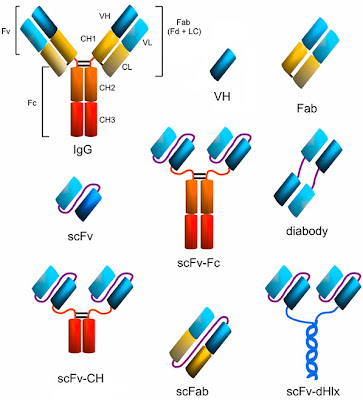
Actualmente, la tecnología ha mejorado con el empleo de la metodología de DNA recombinante y la ingeniería de anticuerpos donde ahora los genes de anticuerpos pueden ser clonados, y expresados exitosamente como fragmentos en bacterias, en células de mamífero o de levaduras, plantas e incluso en insectos. Una ventaja de esta nueva tecnología es que se puede mantener intacto el sitio de unión al antígeno, el parátopo, mientras se reduce el tamaño de la molécula de anticuerpo, comparado con el anticuepro del que proviene. Este anticuerpo minimizado tiene varias ventajas en la práctica clínica tales como una mejor penetración a tumores, se eliminan rápidamente de circulación sanguínea, y resultan con poco tiempo de retención en los tejido que no son blanco específico y además, se reduce la inmunogecicidad. Adicionalmente permite la expresion funcional del aticuerpo en bacterias y en fagos filamentosos. En suma, la combinación de pequeñas moléculas de anticuerpo y sistemas microbianos de producción permiten producir de un proteínas homgeneas en cantidades suficientes para propósitos de diagnóstico y tratamiento, así como estudios estructurales de cada una de las moléculas.
Así, con la última tecnología, varios grupos de investigación han contribuido a la produccción de una amplia variedad de anticuerpos construidos genéticamente, en dodne se inlcuyen: fragmentos Fav, fragmentos Fav en los que los dominios V están unidos por enlaces no covalentes y los llamados anticuerpos scFv, en donde que los genes de VH y VL están unidos a través de un pequeño péptido flexible, un 'linker', o por un puente disulfuro. Alternativamente, las moléculas de anticuerpos minimizados pueden servir de cimientos para construir nuevas proteínas recombinantes con diferentes propósitos.
También se han fusionado exitosamente anticuerpos con la misma afinidad con el bjetivo de construir anticuerpos bivalentes o multivalentes, y la fusión de dos fragmentos de anticuerpos con diferentes especificidades para construir anticuerpos con dos especificidades diferentes.
Toda la información ha sido tomada de:
Zuhaida Asra Ahmad, Swee Keong Yeap, Abdul Manaf Ali, Wan Yong Ho, Noorjahan Banu Mohamed Alitheen, and Muhajir Hamid, “scFv Antibody: Principles and Clinical Application,” Clinical and Developmental Immunology, vol. 2012, Article ID 980250, 15 pages, 2012. doi:10.1155/2012/980250